2 comments
Teori Atom
Teori Atom dan Perkembangannya – Sobat hitung kali ini kita akan belajar mengenai teori atom dan sejarah perkembangannya dari toeri atom sebelum masehi hingga teori atom modern.
Pengertian Atom Banyak versi mengenai pengertian atom. Salah satu konsep ilmiah tertua menyatakan bahwa semua materi dapat dipecah menjadi zarah (partikel) terkecil, dimana partikel-partikel itu tidak bisa dibagi lebih lanjut yang kemudian disebut atom. Jika dilihat dari asal katanya, atom berasal dari bahasa yunani yang berasal dari 2 frasa “a” dan “tomos”, “a” berarti tidak dan “tomos” berarti memotong, jadi secara asal katanya pengertian atom adalah sesuatu yang tidak bisa dipotong (lagi).
Perkembangan Teori Atom
Perkembangan Teori Atom Sebelum Masehi
 Diawali dari seorang filsuf Yunani yang bernama Leucippus (gambar samping) pada tahun 400 SM. Mereka mengemukakan teori atomisme. Toeri atom ini menyebutkan bahwa semua benda terdiri dari bagian-bagian terkecil (tidak bisa dibagi lagi) yang disebut atom. Menurut teori atomisme (teori atom), jika kita mengambil sepotong kayu dan dipotong mejadi 2 bagian yang sama secara terus menerus, akhirnya kita akan menemukan bagian yang tidak bisa kita potong lagi. Teori atomisme ini kemudian dijelaskan lebiih terperinci oleh muridnya Democratis. Teori atom kemudian terus berkembang seiring dengan perkembangan pemikiran manusia saat itu.
Diawali dari seorang filsuf Yunani yang bernama Leucippus (gambar samping) pada tahun 400 SM. Mereka mengemukakan teori atomisme. Toeri atom ini menyebutkan bahwa semua benda terdiri dari bagian-bagian terkecil (tidak bisa dibagi lagi) yang disebut atom. Menurut teori atomisme (teori atom), jika kita mengambil sepotong kayu dan dipotong mejadi 2 bagian yang sama secara terus menerus, akhirnya kita akan menemukan bagian yang tidak bisa kita potong lagi. Teori atomisme ini kemudian dijelaskan lebiih terperinci oleh muridnya Democratis. Teori atom kemudian terus berkembang seiring dengan perkembangan pemikiran manusia saat itu.
Teori Atom Dalton
John Dalton
Seorang pria berkebangsaan inggris yang bernama John Dalton mengemukakan sebuah teori atom yang kemudian dikenal dengan teori atom dalton. Dalam teori atomnya, pria kelahiran 6 September 1766 ini mengemukakan bahwa :
Materi atau unsur itu tersusun atas partikel yang tidak dapat dibagi lagi yang disebut atom.Atom dari unsur yang sama akan identik dari segi ukuran, bentuk, dan massa. Sebaliknya atom dari unsur yang berbeda mempunyai sifat yang berbeda. Ini menunjukkan bahwa pada prinsipnya dalton setuju (tidak menyalahkan) teori atom dari Leucippus dan Democritus.Senyawa terbentuk oleh kombinasi dari dua atau lebih jenis atom.Reaksi kimia adalah suatau penyusunan ulang kombinasi atom dari senyawa-senyawa perekasi membentuk unsur/senyawa baru sebagai hasil reaksi.Teori Atom ThompsonTeori atom ini muncul setelah cukup lama teori dalton bertahan. Tahun 1898 teori dalton mulai goyah. Teori atom Thompson membantah kalau atom adalah bagian terkecil dari materi yang tidak bisa dibagi lagi. Menurut Thompson, atom adalah bola bermuatan positif yang dinetralkan oleh elektron yang tersebat di seluruh bagian bola tersebut. Jadi bagian yang terkecil bukan atom melainkan elektron. Teori ini bayak dikenal dengan nama teori kismis karena kalau kita menggambar atom menurut teori ini akan tampak seperti roti kismis.
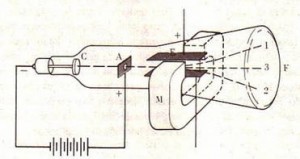
 Thompson melakukan percobaan sebagi berikut
Thompson melakukan percobaan sebagi berikut
percobaah thompson
Kode C = Katoda; A = Anoda; E = lempeng kondensor bermuatan listrik; M = magnet; F = layar berfluoresens.
Berkas 1 : Hanya dengan adanya medan listrik, berkas sinar katoda dibelokkan keatas menyentuh layar pada titik 1.
Berkas 2 : Hanya dengan adanya medan magnit, berkas sinar katoda dibelokkan kebawah menyentuh layar pada titik 2.
Berkas 3 : Berkas sinar katoda akan lurus dan menyentuh layar dititik 3, bila medan listrik dan medan magnit sama besarnya
Berdasarkan eksperimennya Thomson mengukur bahwa kecepatan sinar katoda jauh lebih kecil dibandingkan kecepatan cahaya, jadi sinar katoda ini bukan merupakan REM. Selain itu Ia juga menetapkan perbandingan muatan listrik (e) dengan massa (m). Hasil rata-rata e/m sinar katoda kira-kira 2 x 108 Coulomb per gram. Nilai ini sekitar 2000 kali lebih besar dari e/m yang dihitung dari hidrogen yang dilepas dari elektrolisis air (Thomson menganggap sinar katoda mempunyai muatan listrik yang sama seperti atom hidrogen dalam elektrolisis air.
Kesimpulan : Partikel sinar katoda bermuatan negatif dan merupakan partikel dasar suatu benda yang harus ada pada setiap atom. Pada tahun 1874 Stoney mengusulkan istilah elektron
Teori Atom Rutherford
Teori atom ini muncul di awal tahun 1900-an. Dialah Ernest Rutherford seorang fisikawan asal swedia. Ia melakukan uji terhadap model atom Thompson menggunakan hamburan sinar alfa yang ditembakkan pada lempeng emas tipis. Ia membantah kalau atom adalah bola pejal yang bermuatan positif buktinya ketika ia menembakkan partikel sinar alfa ke lempeng tipis emas dan mendeteksinya dengan layar yang dilapisi seng sulfida, walaupun sebagian besar partikel diteruskan, tetapi ada sekitar 1 dari 800 yang dibelokkan bahkan ada diantarnya yang dipantulkan kembali.
sinar alfa dan lempeng tipis emas
Sebagian besar dari atom kosong, ini karena sebagian besar partikel sinar alfa diteruskanMassa atom keseluruhan terkonsentrasi di pusat atom yang disebut nukleus (inti) yang ukurannya sangat kecil jika dibandingkan atom keseluruhan.Inti atom terdiri dari partikel-partikel yang bermuatan positifMuatan pada inti atom sama dengan jumlah muatan yang dikandung oleh semua elektronElektron berputar di sekitar inti dalam orbit lingkaran yang berbeda layaknya planet yang mengitari matahari
Dari teori atom Rutherford mulai dikenal lah inti atom.
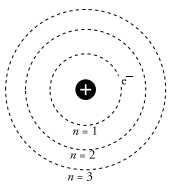
Teori Atom Niels Bohr
model atom niels bohr
Niels Bohr menerapkan teori kuantum untuk struktur atom Rutherford dengan mengasumsikan bergeraknya elektron dalam orbit stasioner ditentukan oleh momentum sudut mereka. Hal ini menyebabkan perhitungan tingkat energi yang mungkin untuk orbit dan postulasi bahwa emisi cahaya terjadi ketika sebuah elektron bergerak ke orbit energi yang lebih rendah. Fisikawan asal Denmark ini melakukan percobaan dengan mengamati spektrum atom hidrogen. Spektrum hidrogen yang ia amati ternyata membentuk garis-garis yang terpisah menurut aturann tertentu. Garis-garis terpisah merupakan merupakan lintasan elektron yang
masing-masing mempunyai tingkat energi tertentu. Kesimpulan yang diambil dari pengamata Niels Bohr sebagai berikut :
Atom tersusun atas inti atom bermuatan positif yang dikelilingi elektron yang bermuatan negatif.Dalam mengelilingi inti, elektron bergerak dalam jarak tertentu yang disebut lintasan.Selama melintasi inti, elektron tidak memancarkan maupun menyerap energi.Elektron dapat berpindah dari lintasa semula ke lintasan yang lebih tinggi (lebih luar) dengan menyerap energi. Sebaliknya, elektron bisa berpindah ke lintasan yang lebih rendah dengan melepas atau memancarkan energi.
Teori Atom Mekanika Kuantum
Kelemahan model atom yang dikemukakan Rutherford kemudian disempurnakan oleh Niels Henrik David Bohr, model ini kemudian dikenal dengan model atom Rutherford-Bohr. Tingkat energy elektron digunakan untuk menerangkan terjadinya spektrum atom yang dihasilkan oleh atom yang mengeluarkan energi berupa radiasi cahaya. Namun ada kelemahan dari teori atom yang diungkapkan Rutherford, Model Atom Rutherford tidak dapat menerangkan energi yang dilepaskan dalam bentuk cahaya, sebab pada setiap kali perputaran elektron dengan percepatan tetap, elektron kehilangan energi dan akhirnya tertarik ke inti.
Perilaku seperti ini menimbulkan gerakan berbentuk spiral, dan berakhir dengan jatuhnya elektron ke inti. Pada kenyataanya, atom bersifat mantap dan stabil. Inilah yang coba dijawab oleh teori atom mekanika kuantum.Max Planck pada tahun 1900 mengemukakan teori kuantum yang menyatakan bahwa atom dapat memancarkan atau menyerap energi hanya dalam jumlah tertentu (kuanta). Jumlah energi yang dipancarkan atau diserap dalam bentuk radiasi elektromagnetik disebut kuantum. Adapun besarnya kuantum dinyatakan dalam persamaan
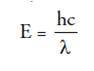 E = energi radiasi (Joule = J)
E = energi radiasi (Joule = J)
h = konstanta Planck (6,63 x 10-34 J.s)
c = cepat rambat cahaya di ruang hampa (3 x 108 ms-1)
l = panjang gelombang (m)
Kelemahan model atom Niels Bohr
Dalam percobaannhya Niels Bohr menggunakan atom hidrogen karena dianggap paling sederhana, hanya satu atom dan satu elektron. Bohr bisa menerangkan spektrum hidrogen dengan baik tapi ia belum bisa menjelaskan untuk atom yang berelektron lebih dari 1.
Pada tahun 1924, ahli fisika dari Perancis bernama Louis de Brogliemengemukakan bahwa partikel juga bersifat sebagai gelombang. Dengan demikian, partikel mempunyai panjang gelombang.Dari penelitian De Broglie diketahui bahwa teori atom Bohr memiliki kelemahan. Kelemahan itu ada pada pernyataan Bohr yang menyebutkan bahwa elektron bergerak mengelilingi inti atom pada lintasan tertentu berbentuk lingkaran. Padahal, elektron yang bergerak mengelilingi inti atom juga melakukan gerak gelombang. Gelombang tersebut tidak bergerak sesuai garis, tetapi
menyebar pada suatu daerah tertentu.
Pada tahun 1927, Erwin Schrodinger menyempurnakan teori atom Bohr. Ia menyatakan bahwa elektron dapat dianggap sebagai gelombang materi dengan gerakan menyerupai gerakan gelombang. Teori ini lebih dikenal dengan mekanika gelombang (mekanika kuantum).
Teori atom Schrodinger memiliki persamaan dengan model atom Bohr yaitu adanya tingkat energi dalam atom. Perbedaannya, model atom Bohr memiliki lintasan elektron yang pasti. Sedangkan pada model atom Schrodinger, lintasan elektronnya tidak pasti karena menyerupai gelombang yang memenuhi ruang (tiga dimensi). Menurut teori atom ini elektron menempati lintasan yang tidak pasti sehingga electron berada pada berbagai jarak dari inti atom dan berbagai arah dalam ruang. Jadi, daerah pada inti atom dengan kemungkinan terbesar ditemukannya elektron dikenal sebagai orbital.
Sekian dulu teori atom dari rumushitung.com. Semoga rangkuman teori atom berikut perkembangannya bermanfaat. Selamat Belajar. ![]()
Yuk Bagikan
FacebookTwitterGoogle+WhatsAppShare
Related
Salah satu bagian dari sejarah perkembangan tabel periodik unsur adalah saat John Wolfgang Dobereiner menemukan teori triade dobereiner. Dobereiner pada…
 Partikel Dasar Penyusun Atom – Kimia X
Partikel Dasar Penyusun Atom – Kimia X
Partikel Dasar Penyusun Atom – Atom merupakan puing terkecil dari suatu zat yang memiliki sifat tidak bisa di bagi lagi.…
 Menentukan Rumus Empiris dan Rumus Molekul
Menentukan Rumus Empiris dan Rumus Molekul
Menentukan Rumus Empiris dan Rumus Molekul – Ketika sobat belajar kimia di kelas X SMA bab materi dasar kimia, kalian…
Previous PostPerubahan Wujud Zat
Next PostRumus Cepat Persamaan Kuadrat | Matematika
2 responses
Fatiha Meliana Kurniawati
September 1, 2013
isotop adalah unsur-unsur/atom yang mempunyai jumlah nomor atom sama.
isoton unsur-unsur/atom yang mempunyai jumlah neutron sama.
isobar adalah unsur-unsur/atom yang mempunyai jumlah nomor massa sama.
Leave a Reply
Name*
E-Mail*
Website
Publish
© 2015 Rumushitung.com




Tidak ada komentar:
Posting Komentar